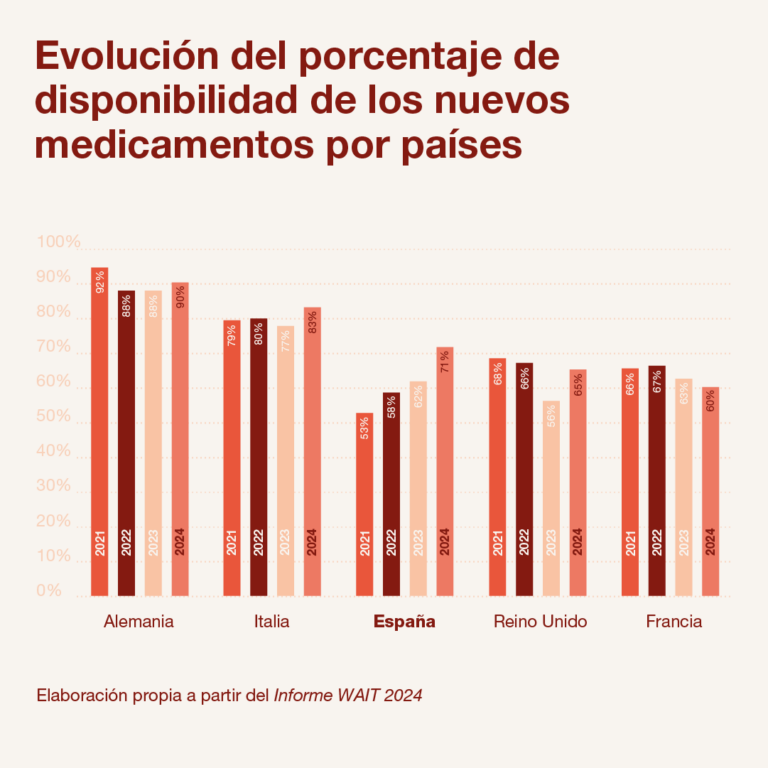
España ha incrementado notablemente su disponibilidad de medicamentos innovadores dentro del sistema sanitario público, alcanzando la financiación del 71% de los fármacos aprobados por la Agencia Europea de Medicamentos (EMA) entre 2020 y 2023. Así lo refleja el informe Indicadores de acceso a terapias innovadoras en Europa 2024 (W.A.I.T. Indicator), publicado por la Federación Europea de la Industria Farmacéutica (Efpia), que coloca a nuestro país entre los que más han avanzado en este ámbito en los últimos años.
El informe, elaborado por la consultora Iqvia, detalla que de los 173 medicamentos autorizados por la EMA en el periodo analizado, España ha financiado 123. Esta mejora, cercana a los 20 puntos porcentuales desde 2019, sitúa a España por encima de países tradicionalmente más rápidos en este proceso, como Reino Unido o Francia. Sin embargo, esta tendencia positiva convive con retos importantes que afectan directamente a los pacientes, especialmente en lo relativo a los tiempos de espera y la existencia de restricciones en el uso de los medicamentos aprobados.
- Te interesa: Pacientes con fibrosis quística exigen equidad en el acceso a tratamientos y más investigación
A pesar del aumento en la disponibilidad, el acceso efectivo para los pacientes sigue marcado por largas demoras. El tiempo medio de espera en España para que un medicamento innovador esté disponible tras su autorización europea es de 616 días, es decir, más de 20 meses. Esta cifra, aunque ligeramente inferior a la registrada en 2023, sigue superando con creces los 180 días que establece la legislación europea como límite para la toma de decisiones sobre financiación.
Incluso si se toma como referencia el momento en que la compañía farmacéutica expresa formalmente su interés en comercializar el fármaco en España —es decir, cuando obtiene el Código Nacional—, el periodo medio se reduce a 504 días, aún muy por encima del estándar europeo.
Acceso restringido
Otro dato preocupante que revela el informe es que más de la mitad de los medicamentos innovadores financiados en España (52%) presentan algún tipo de restricción en su uso. Esto implica que 64 de los 123 fármacos con financiación aprobada están limitados por indicación terapéutica, tipo de paciente o condiciones específicas de uso.
En contraste, países como Alemania o los Países Bajos aplican muchas menos restricciones o directamente ninguna. Esta situación plantea serias dudas sobre la equidad en el acceso a las terapias, especialmente para pacientes con enfermedades graves o sin alternativas terapéuticas. “Financiar un medicamento con restricciones puede dejar fuera a muchos pacientes que sí podrían beneficiarse del tratamiento según las indicaciones autorizadas por la EMA”, advierte Isabel Pineros, directora de Prestación Farmacéutica y Acceso de Farmaindustria.
Los datos del Ministerio de Sanidad
Por su parte, el Ministerio de Sanidad ha publicado un estudio previo que asegura que el tiempo medio para decidir la financiación de un medicamento innovador en España se ha reducido a 344 días, lo que representa una disminución de 175 días respecto a los 519 días registrados en 2020. La diferencia de cifras frente al informe de Efpia se debe a que el documento gubernamental incluye el acceso a medicamentos a través de la vía de Medicamentos en Situaciones Especiales (MSE), como el uso compasivo, que permite la disponibilidad de tratamientos antes de su financiación oficial.
No obstante, desde el Ministerio se reconoce que es un tiempo muy superior a los 180 días que marca la normativa europea y que son necesarios cambios en los procedimientos de evaluación y decisión de precio y financiación. Para conseguirlo, se están preparando nuevos reales decretos relacionados con estos aspectos.



